像人类这样的复杂生物体是如何从单一细胞(受精卵)发育成具有成人特征的大量细胞类型(例如神经细胞、肌肉细胞和上皮细胞)? 在整个发育和成年期,细胞分化的过程导致细胞呈现其最终的形态学〔morphology〕和生理学。 分化〔Differentiation〕是非特化〔unspecialized〕细胞变得特化〔specialized〕,以执行不同功能的过程。
幹細胞
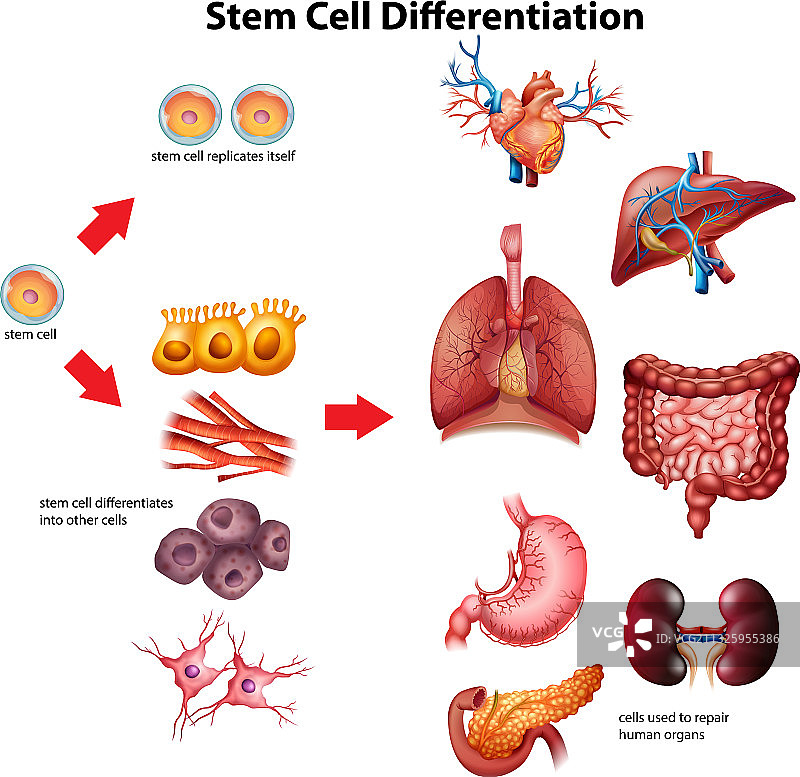
干细胞〔stem cell〕干细胞〔stem cell〕是一种非特化细胞,可以根据需要无限制地分裂,并且在特定条件下可以分化为特化细胞。 干细胞依其分化潜力分为几类。
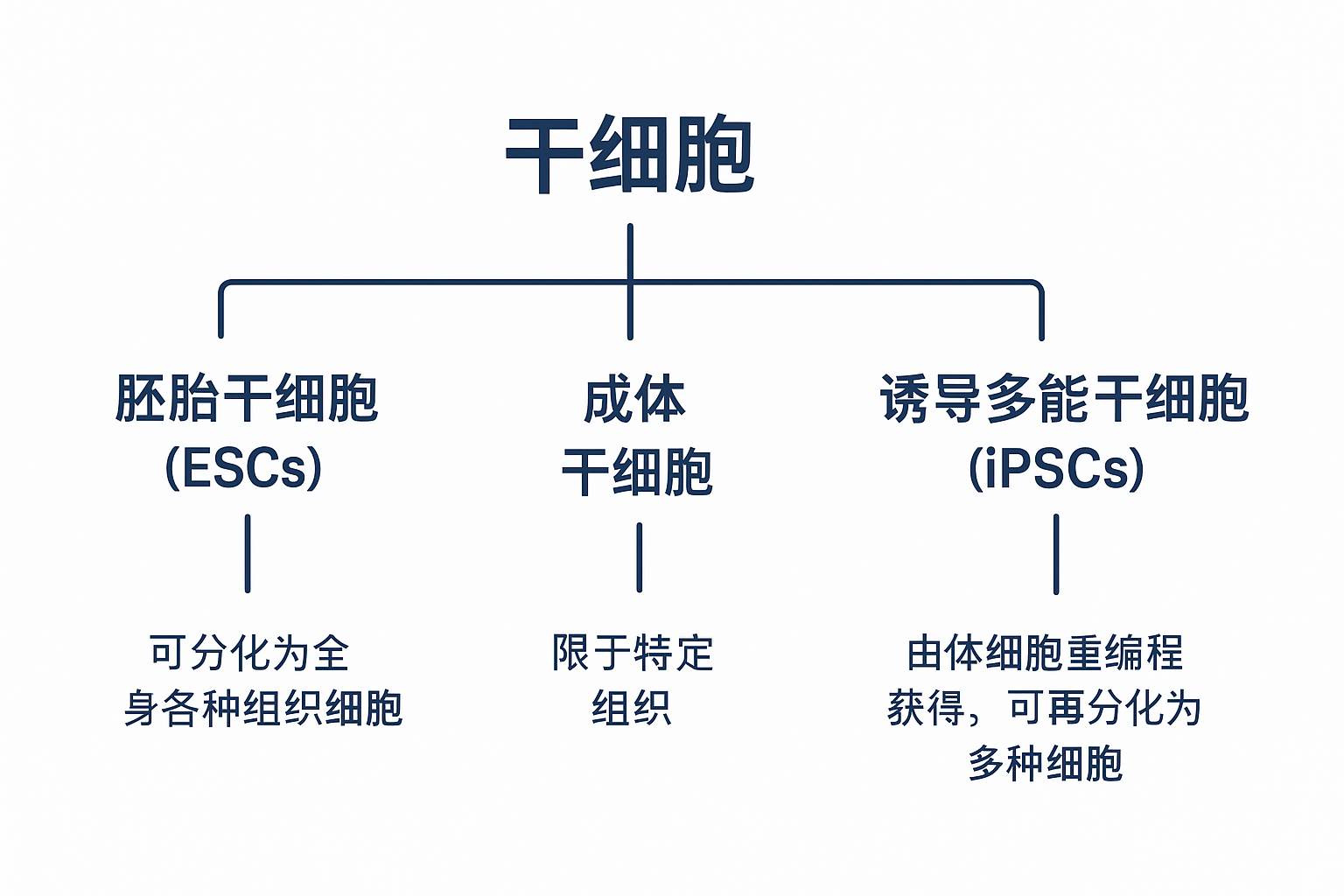
受精卵〔zygote〕分裂产生的第一个胚胎细胞是最终的干细胞; 这些干细胞被描述为全能的〔totipotent〕,因为它们有可能分化成生物体生长和发育所需的任何细胞。
由全能干细胞〔totipotent stem cells〕发育而来的胚胎细胞,它们是胚胎的基本组织层的前体,被分类为万能干细胞。 万能干细胞〔pluripotent stem cell〕是一种具有分化成任何类型人体组织的潜力,但无法支持生物体全面发育的细胞。 这些细胞随后变得更加特化,被称为多能细胞〔multipotent cells〕。〔multipotent cells〕。
多能干细胞〔multipotent stem cell〕具有分化成给定细胞谱系〔given cell lineage〕或少量谱系〔small number of lineages〕内不同类型细胞的潜力,例如红血球或白血球。
最后,多能细胞〔multipotent cells〕可以进一步成为特化的寡能细胞〔oligopotent cells〕。 寡能干细胞〔oligopotent stem cell〕仅限于成为几种不同细胞类型中的一种。 相较之下,单能细胞〔unipotent cell〕是完全特化的,只能繁殖以产生更多其自身特定的细胞类型。
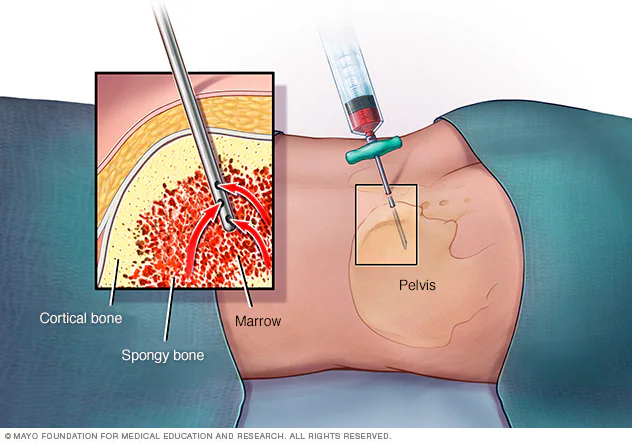
干细胞的独特之处在于它们还可以不断分裂和再生新的干细胞,而不是进一步特化〔specializing〕。 〔specializing〕。 人类生命的不同阶段存在着不同的干细胞。 它们包括胚胎〔embryo〕的胚胎干细胞〔embryonic stem cells〕、胎儿〔fetus〕的胎儿干细胞〔fetal stem cells〕和成人〔adult〕的成体干细胞〔adult stem cells〕。 成体干细胞的一种类型是上皮干细胞〔epithelial stem cell〕,它在皮肤表皮的多层上皮细胞中产生角质形成细胞〔keratinocytes〕。 成人骨髓有三种不同类型的干细胞:造血干细胞〔hematopoietic stem cells〕(产生红血球、白血球和血小板)(图 3.34); 内皮干细胞〔endothelial stem cells〕(产生排列在血管和淋巴管上的内皮细胞类型); 和间质干细胞〔mesenchymal stem cells〕(产生不同类型的肌肉细胞)。

造血过程涉及多能细胞〔multipotent cells〕分化为血液和免疫细胞。 多能造血干细胞产生许多不同的细胞类型,包括免疫系统的细胞和红血球。
分化
当细胞分化(变得更加特化)时,它的大小、形状、代谢活动和整体功能可能会发生重大变化。 因为从受精卵开始,体内的所有细胞都含有相同的 DNA,那么不同的细胞类型为何会如此不同呢? 答案类似电影剧本。 电影中的不同演员都会读同一个剧本,但他们每个人都只读自己的剧本部分。 同样,所有细胞都含有相同的完整 DNA,但每种类型的细胞仅“读取〔reads〕”与其自身功能相关的 DNA 部分。 在生物学中,这被称为每个细胞的独特基因表现。
为了使细胞分化成其特殊的形式和功能,它只需要操纵那些将被表达的基因(以及那些蛋白质),而不是那些将保持沉默的基因。 基因“开启”或“关闭”的主要机制是透过转录因子。 转录因子〔transcription factors〕是一类〝与 DNA 分子上的特定基因结合并促进或抑制其转录〞的蛋白质之一(图 3.35)。

虽然每个身体细胞都包含生物体的整个基因组,但不同的细胞透过使用各种转录因子来调节基因表现。 转录因子是一种〝影响 RNA 聚合酶与 DNA 分子上特定基因结合〞的蛋白质。
干细胞研究
干细胞研究旨在寻找〝利用干细胞再生和修复细胞损伤〞的方法。 随着时间的推移,大多数成体细胞会经历老化的磨损,并失去分裂和自我修复的能力。 干细胞不表现出特定的形态或功能。 成体干细胞作为大多数组织中的一小部分细胞存在,不断分裂并可分化成通常由该组织形成的许多特殊细胞。 这些细胞使身体能够更新和修复身体组织。
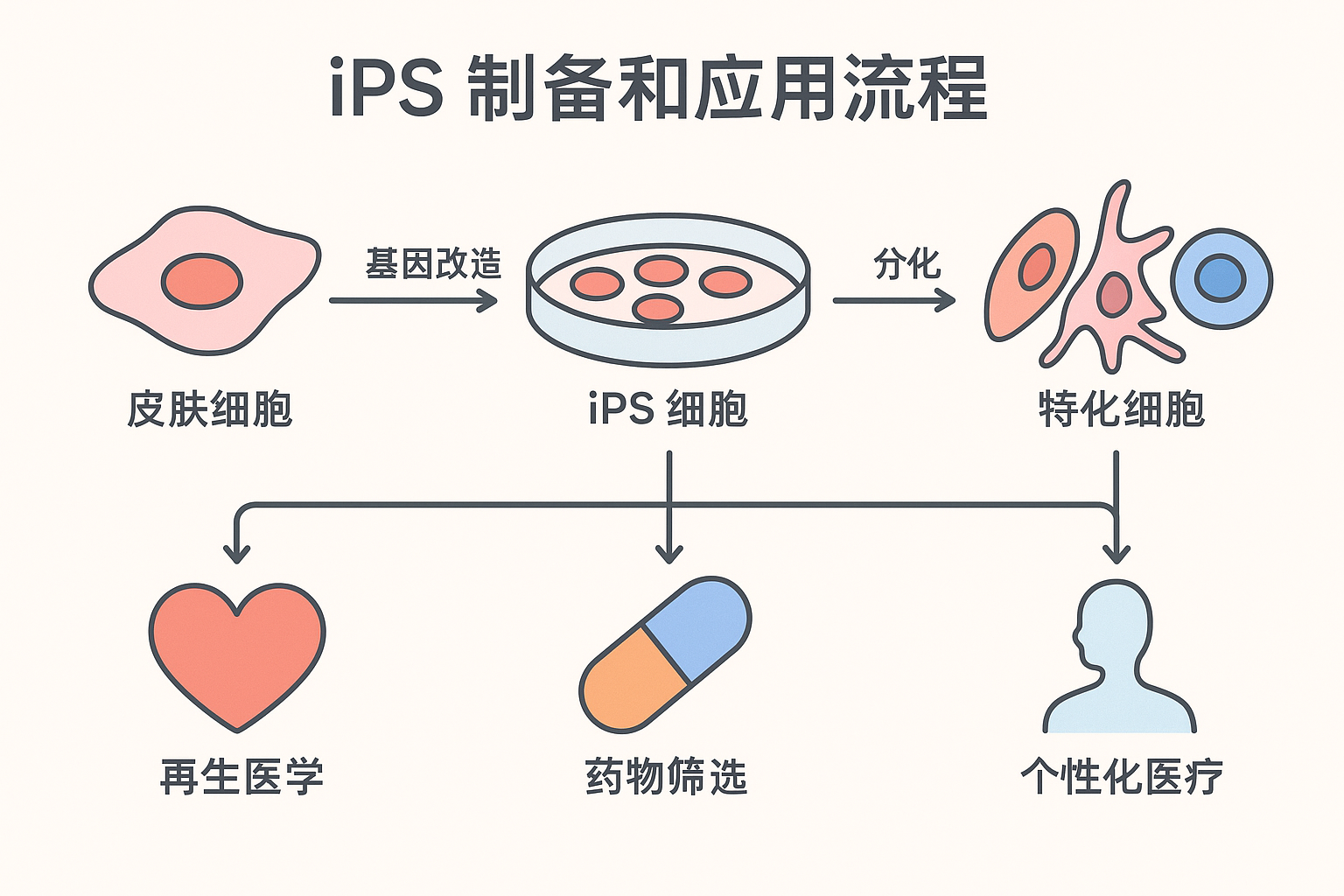
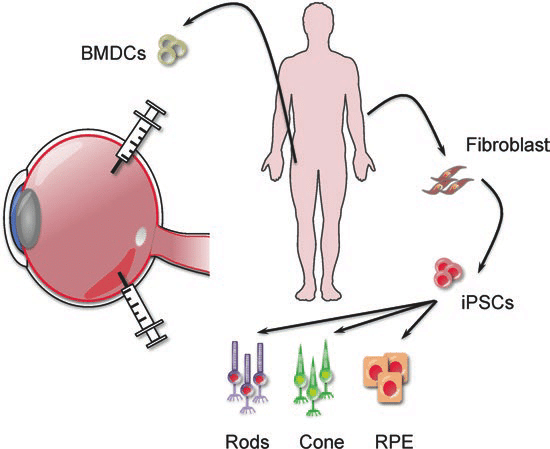
人们对诱导未分化细胞变成特化细胞的机制所知甚少。 在实验室环境中,可以透过改变生长的物理和化学条件,来诱导干细胞分化为特化细胞。 实验中使用了几种干细胞来源,并根据其来源和分化潜力进行分类。 人类胚胎干细胞〔human embryonic stem cells〕 (hESC) 从胚胎中提取,具有万能性〔pluripotent〕。 存在于许多器官和分化组织(例如骨髓和皮肤)中的成体干细胞是多能性的〔multipotent〕,其分化仅限于这些组织中发现的细胞类型。 从脐带血〔umbilical cord blood〕中分离的干细胞也是多潜能性的,乳牙〔deciduous teeth〕(乳牙〔baby teeth〕)的细胞也是。 研究人员最近从小鼠和人类成体干细胞中开发出诱导性万能干细胞〔induced pluripotent stem cells〕(iPSC)。 这些细胞是经过基因重编写〔genetically reprogrammed〕的多能性成体细胞〔multipotent adult cells〕,其功能类似胚胎干细胞; 它们能够产生所有三个胚层的细胞特征。
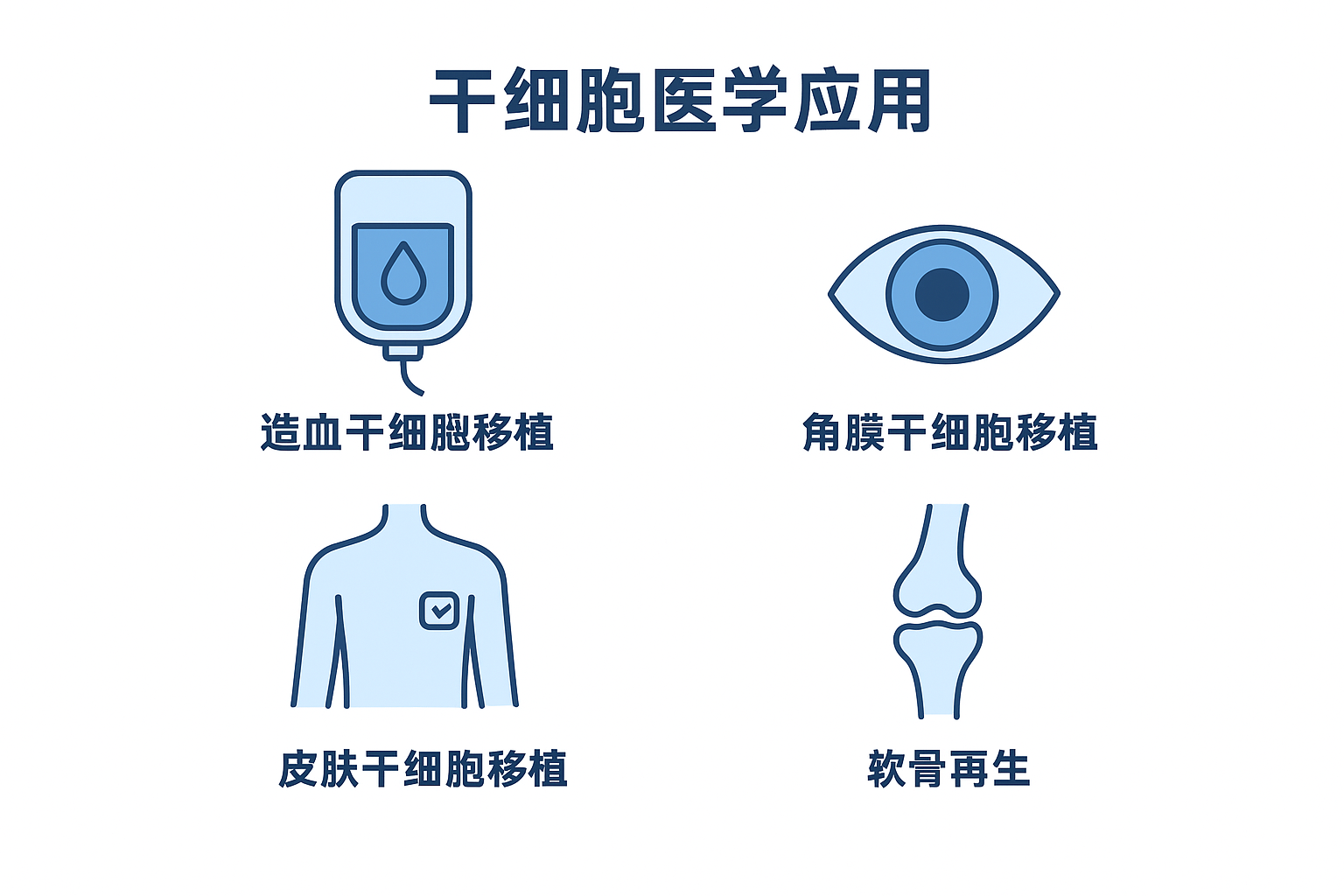
由于干细胞具有分裂和分化为特化细胞的能力,因此它们为糖尿病和心脏病等疾病提供了潜在的治疗方法(图 3.36)。 细胞疗法〔Cell-based therapy〕是指〝在生长皿中诱导分化的干细胞〞将之注射到患者体内以修复受损或破坏的细胞或组织的治疗。 细胞疗法的应用必须克服许多障碍。 尽管胚胎干细胞具有几乎无限范围的分化潜力,但它们被患者的免疫系统视为外来细胞,并可能引发排斥反应。 此外,透过破坏胚胎来分离胚胎干细胞也引发了相当大的伦理和法律问题。

干细胞具备分化为特定细胞的能力,使它们在治疗应用中具有潜在价值,旨在替换不同身体组织中受损细胞。
相较之下,从患者身上分离出来的成体干细胞不会被身体视为外来细胞,但它们的分化范围有限。 有些人会储存孩子的脐带血或乳牙,储存这些干细胞来源以备将来孩子需要时使用。 诱导性万能干细胞〔induced pluripotent stem cells〕被认为是该领域的一个有希望的进步,因为使用它们可以避免胚胎干细胞的法律、伦理和免疫学隐患〔immunological pitfalls〕的问题。





Comment
No comments yet.
No trackbacks yet.